Exercícios
01 - (UEG GO) - A estrutura abaixo representa um carbocátion terciário, o qual pode ser formado em reações de substituição de haletos de alquila com espécies química nucleofílicas e na presença de solventes adequados.
A análise de sua estrutura permite concluir que essa espécie química apresenta uma geometria
a) linear.
b) piramidal.
c) tetraédrica.
d) trigonal planar.
e) quadrado planar.
02 - (UFF RJ) - A química está na base do desenvolvimento econômico e tecnológico. Da siderurgia à indústria da informática, das artes à construção civil, da agricultura à indústria aeroespacial, não há área ou setor que não utilize em seus processos ou produtos algum insumo de origem química. Um desses insumos é o metano, gás natural, usado como combustível na indústria química. A queima do metano pode ser representada pela seguinte equação:
CH4(g) + 2O2(g) ®CO2(g) + 2H2O
Em relação ao metano (CH4) e ao dióxido de carbono (CO2), pode-se dizer que a forma geométrica de cada um desses compostos, respectivamente, é
a) tetraédrica e trigonal planar.
b) tetraédrica e linear.
c) quadrática planar e trigonal planar.
d) quadrática planar e linear.
e) tetraédrica e quadrática planar.
03 - (UCS RS) - Quando um vulcão entra em erupção com força explosiva suficiente, as cinzas vulcânicas, contendo dióxido de enxofre, podem atingir a estratosfera. Lá, fenômenos físico-químicos criam uma fina camada de partículas esbranquiçadas que, durante meses ou anos, circundam a Terra e refletem parte dos raios solares, impedindo que a radiação atinja o solo. Como resultado desse fenômeno, pode ocorrer um resfriamento do planeta.
O dióxido de enxofre eliminado pelos vulcões
a) é uma molécula apolar.
b) é um óxido anfótero.
c) forma uma base ao reagir com a água.
d) possui duas ligações covalentes coordenadas em sua estrutura.
e) apresenta geometria angular.
04 - (UFMT) - A teoria da repulsão dos pares eletrônicos sustenta: ao redor do átomo central, pares eletrônicos ligantes e não ligantes se repelem, tendendo a ficar tão afastados quanto possível. De acordo com essa teoria, quais estruturas podem ser previstas para as moléculas de SF6, PCl5, CH4, respectivamente?
a) tetraédrica, bipirâmide trigonal e octaédrica.
b) octaédrica, bipirâmide trigonal e tetraédrica.
c) bipirâmide trigonal, tetraédrica e tetraédrica.
d) tetraédrica, tetraédrica e octaédrica.
e) octaédrica, tetraédrica e bipirâmide trigonal.
05 - (UNICID) - A desinfecção de águas residuárias de uso agrícola é um processo indispensável à proteção da saúde pública. O ozônio, O3, pode ser utilizado para esse fim, já que é bastante eficiente na destruição de organismos patogênicos. Sobre as propriedades do ozônio, pode-se afirmar que é constituído por moléculas com geometria
a) trigonal e é um isótopo do gás oxigênio.
b) trigonal e é um alótropo do gás oxigênio.
c) linear e é um alótropo do gás oxigênio.
d) angular e é um isótopo do gás oxigênio.
e) angular e é um alótropo do gás oxigênio.
06 - (UFMA) - São exemplos de estruturas lineares:
Dados: 1H1, 4Be9, 6C12,7N14, 8O16, 9F19,16S32, 17Cl35,5
a) N2, H2O
b) BeCl2, SO2
c) CO2, Cl2O
d) HCN, N2O
e) N2O, OF2
07 - (UFV MG) - Em relação à geometria das moléculas de água, amônia, metano e etino, assinale a alternativa CORRETA:
a) H2O, angular; NH3, piramidal; CH4, tetraédrica; C2H2, quadrática plana.
b) H2O, angular; NH3, trigonal plana; CH4, quadrática plana; C2H2, linear.
c) H2O, linear; NH3, trigonal plana; CH4, tetraédrica; C2H2, linear.
d) H2O, angular; NH3, piramidal; CH4, tetraédrica; C2H2, linear.
e) H2O, linear; NH3, tetraédrica; CH4, quadrática plana; C2H2, trigonal plana.
08 - (UFTM MG) - O Protocolo de Montreal completou 20 anos, e os progressos alcançados já podem ser notados. Segundo um ranking compilado pelas Nações Unidas, o Brasil é o quinto país que mais reduziu o consumo de CFCs (clorofluorcarbonos), substâncias que destroem a camada de ozônio (O3). O acordo para redução desses poluentes foi assinado em 1987 por 191 países, que se comprometeram em reduzir o uso do CFC em extintores de incêndios, aerossóis, refrigeradores de geladeiras e ar condicionado. Os CFCs podem ser compostos constituídos de um ou mais átomos de carbono ligados a átomos de cloro e/ou flúor.
A molécula de ozônio apresenta geometria molecular
a) angular.
b) linear.
c) piramidal.
d) tetraédrica.
e) trigonal plana.
09 - (IME RJ) - A teoria da repulsão dos pares de elétrons da camada de valência foi desenvolvida pelo pesquisador canadense Ronald J. Gillespie, em 1957. Esta teoria permite prever a forma geométrica de uma molécula. O modelo descreve que, ao redor do átomo central, os pares eletrônicos ligantes e os não ligantes se repelem, tendendo a ficar tão afastados quanto possível, de forma que a molécula tenha máxima estabilidade. A seguir são expressas algumas correlações entre nome, geometria molecular e polaridade de algumas substâncias.
Assinale a correlação falsa.
a) I
b) II
c) III
d) IV
e) V
10 - (UFRN) - A emissão de substâncias químicas na atmosfera, em níveis elevados de concentração, pode causar danos ao ambiente. Dentre os poluentes primários, destacam-se os gases CO2, CO, SO2 e CH4. Esses gases, quando confinados, escapam lentamente, por qualquer orifício, por meio de um processo chamado efusão.
A molécula que apresenta geometria tetraédrica é
a) CO2
b) SO2
c) CO
d) CH4
e) HCl
GABARITO
1) D 2) B 3) E 4) B 5) E 6) D 7) D 8) A 9) C 10) D
sábado, 19 de maio de 2012
Lista de Exercícios - 50 - Estequiometria
Estequiometria envolvendo uma reação sem excesso de reagente
1. Certa quantidade de cobre reagiu completamente com 2,52 g de HNO3. Calcule:
3 Cu + 8 HNO3 → 3 Cu(NO3)2 + 2 NO + 4 H2O
a) o número de átomos de cobre que reagiu;
b) a massa de Cu(NO3)2 formado;
c) a quantidade em mols de H2O formado:
d) O volume de NO formado nas CNTP.
2. Certa quantidade de gás propano C3H8exige na combustão total 48 L de O2 medido nas CNTP.
C3H8 + 5 O2 → 3 CO2 + 4 H2O
Calcule:
a) o volume de propano utilizado;
b) a massa de H2O formada.
3. Na reação:
3 Na2CO3 + 2 H3PO4→ 2 Na3PO4+ 3 H2O + 3 CO2 foram obtidos 1,12 L de CO2nas CNTP. Calcule:
a) a massa de Na2CO3 gasta na reação;
b) a massa de H3PO4 gasta na reação;
c) a massa de Na3PO4 formada na reação.
4. Na reação:
2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2
Foram obtidos 336 mL de H2 nas CNTP.
Calcule:
a) a massa de Al que reagiu;
b) a massa de H2SO4 que reagiu;
c) a massa de Al2(SO4)3formada.
Estequiometria envolvendo uma reação com excesso de reagente
5. 20,52 g de Al2(SO4)3 são adicionados a 31,20 g de BaCl2, ambos em solução aquosa. Ocorre reação com precipitação de BaSO4.
Al2(SO4)3 + 3 BaCl2 → 2 AlCl3 + 3 BaSO4
Calcule:
a) a massa de AlCl3 obtida;
b) a massa de BaSO4 obtida;
c) a massa do reagente em excesso, se for o caso.
6. Cromo metálico pode ser produzido pela redução de Cr2O3com Al segundo a equação:
2 Al + Cr2O3 → Al2O3 + 2 Cr
Supondo reação completa, determine a massa de cromo produzida pela reação de 5,4 kg de Al com 20,0 kg de Cr2O3.
Estequiometria envolvendo pureza do reagente e rendimento de uma reação
7. 15,0 g de pirita (FeS2) de 80% de pureza são submetidos à ustulação.
4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
Calcule:
a) o volume de O2 necessário, nas CNTP;
b) o volume de SO2 obtido nas CNTP;
c) a massa de Fe2O3 obtida.
8. Foram obtidos 448 g de CaO por pirólise de 1 kg de CaCO3. Calcule o rendimento da reação.
9. Qual é a quantidade de CO2 obtida na reação de 7,0 mol de CaCO3 com ácido clorídrico em excesso, sabendo-se que o rendimento da reação é igual a 90%?
10. Calcule a massa de enxofre de 96% de pureza necessária à obtenção de 490 kg de H2SO4 de 80% em massa (pureza) pelo processo abaixo equacionado, sabendo-se que o rendimento do processo é igual a 60%.
S + O2 → SO2
2 SO2 + O2 → 2 SO3
SO3 + H2O → H2SO4
11. Calcule as massas de Fe2O3 de 80% de pureza e de H2SO4 de 73,5% de pureza necessárias à obtenção de 640 g de Fe2(SO4)3, sabendo-se que o rendimento da reação é igual a 80%.
12. 100 g de carbonato de cálcio impuro são tratados com ácido clorídrico. O gás obtido é recolhido convenientemente e pesa 39,60 g. Admitindo-se que as impurezas não reajam com ácido clorídrico, pode-se afirmar que a pureza do carbonato de cálcio vale?
13. O minério usado na fabricação de ferro em algumas siderúrgicas brasileiras contém cerca de 80% de óxido de ferro (III). Quantas toneladas de ferro podem ser obtidas pela redução de 20 toneladas desse minério?
quarta-feira, 15 de junho de 2011
Lista de Exercícios - 49 - Concentração das Soluções
Cálculo da Concentração das Soluções
1. (UFRGS) Numa determinada área urbana, a concentração média do agente poluente SO2 no ar atmosférico atingiu o valor de 3,2 x 10-4 g.m-3. Essa concentração, expressa em mol.L-1 e em moléculas.m-3, corresponde, respectivamente, aos valores
a) 5,0 x 10-6 e 3,0 x 1018.
b) 3,2 x 10-7 e 6,0 x 1020.
c) 5,0 x 10-9 e 2,7 x 1025.
d) 5,0 x 10-3 e 3,0 x 1021.
e) 5,0 x 10-9 e 3,0 x 1018.
2. (UFRGS) Misturando-se 250 mL de solução 0,600 mol/L de KCℓ com 750 mL de solução 0,200 mol/L de BaCℓ2, obtém-se uma solução cuja concentração de íon cloreto, em mol/L, é igual a
a) 0,300.
b) 0,400.
c) 0,450.
d) 0,600.
e) 0,800.
3. (UFRGS) O volume, em mililitros, de uma solução de 0,5 mol/L de AgNO3 necessário para preparar 200 mililitros de uma solução 0,1 mol/L desse sal é igual a
a) 10.
b) 20.
c) 25.
d) 40.
e) 50.
4. (UFRGS) O soro fisiológico é uma solução aquosa que contém 0,9 % em massa de NaCℓ. Para preparar 200 mL dessa solução, a quantidade necessária de NaCℓ é de aproximadamente
a) 0,45 g.
b) 1,8 g.
c) 0,09 mol.
d) 0,18 mol.
e) 10,6 g.
5. (UFPB) Um técnico laboratorial, distraidamente, deixou derramar no chão um frasco de 20 mL de uma solução 0,2 mol/L de ácido sulfúrico. Na prateleira, ele dispunha de uma solução de hidróxido de sódio 0,6 mol/L. Nessa situação, para neutralizar completamente o volume de ácido derramado, será necessário um volume de base igual a:
a) 18,50 mL
b) 20,00 mL
c) 6,66 mL
d) 13,33 mL
e) 26,66 mL
6. (UFRJ) Antigamente, o açúcar era um produto de preço elevado e utilizado quase exclusivamente como medicamento calmante. No século XVIII, com a expansão das lavouras de cana-de-açúcar, esse cenário mudou. Hoje, a sacarose é acessível à maior parte da população, sendo utilizada no preparo de alimentos e bebidas. Um suco de fruta concentrado de determinada marca foi adoçado com 3,42 g de açúcar (sacarose: C12H22O11) em 200 mL de solução. Com este suco, foi preparado um refresco, adicionando-se mais 800 mL de água. A concentração em mol/L de sacarose no suco e a concentração em g/L de sacarose no refresco são, respectivamente
a) 0,05 mol/L e 34,2 g/L.
b) 0,05 mol/L e 3,42 g/L.
c) 0,5 mol/L e 3,42 g/L.
d) 0,5 mol/L e 34,2 g/L.
e) 0,05 mol/L e 342 g/L.
7. (UFSM) Os licores são constituídos principalmente de extrato de plantas, álcool etílico e uma grande quantidade de água e sacarose.
Num copo de Becker, foram misturados 400 mL de solução de sacarose de concentração 57 g/L com 600 mL de solução de concentração 19 g/L do mesmo açúcar. A concentração da sacarose (C12H22O11) em mol L-1, na solução final é, aproximadamente,
a) 0,10
b) 0,34
c) 1,00
d) 3,42
e) 34,20
8. (UFRGS) O atleta Michael Phelps é considerado um fenômeno na natação. Contribui para esse sucesso uma particularidade metabólica que lhe confere uma recuperação fora do comum. Enquanto a maior parte dos nadadores, depois das competições, apresenta uma média de 10 milimols de ácido lático por litro de sangue, o nadador campeão apresenta apenas 5,6 milimols.
Fonte: Veja, n. 2073, p.122, 13 ago. 2008.
As concentrações de ácido lático (C3H6O3), em gramas por litro de sangue, que correspondem, respectivamente, a 10 milimols/L e 5,6 milimols/L, são de aproximadamente
a) 1 x 10-1 e 5,6 x 10-1.
b) 1 x 10-3 e 5,6 x 10-3.
c) 4,5 x 10-1 e 2,5 x 10-1.
d) 9 x 10-1 e 5 x 10-1.
e) 9 x 10-3 e 5 x 10-3.
9. (UFPR) A mistura de 26,7 g de NaCℓ (massa molar 53,4 g.mol-1) em água suficiente para que a solução apresente o volume de 500 mL resulta numa concentração de:
a) 26,7% (m/v).
b) 26,7 g.L-1.
c) 1,0 mol.L-1.
d) 0,0534 g.L-1.
e) 13,35 L.mol.
10. (UFPR) Durante a temporada de verão, um veranista interessado em química fez uma análise da água da Praia Mansa de Caiobá. Pôs para evaporar ao ar livre 200 mL de água dessa praia, e o material sólido resultante ele colocou no forno de sua casa, ligado a 180 °C, por algumas horas. Ao pesar o material resultante, ele encontrou 6 gramas de sólido como resultado. Supondo que o material encontrado pelo veranista era NaCℓ (59 g/mol), assinale a alternativa que apresenta a concentração desse sal na água do mar em mol/L.
a) 0,5.
b) 1.
c) 3,4.
d) 0,2.
e) 0,1.
Gabarito
1[E] 2[C] 3[D] 4[B] 5[D] 6[B] 7[A] 8[D] 9[C] 10[A]
Elaboração: prof. Paulo Silva
Para ter a resolução acesse o link: https://www.mandamais.com.br/download/jni11562011201625
Para ter a resolução acesse o link: https://www.mandamais.com.br/download/jni11562011201625
domingo, 5 de junho de 2011
Lista de Exercícios - 48 - Coeficiente de Solubilidade
Classificação das Soluções Aquosas e Coeficiente de Solubilidade
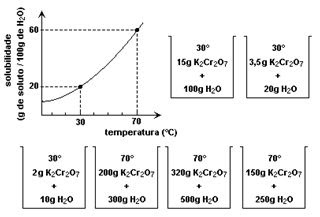
1. (UERJ) O gráfico a seguir, que mostra a variação da solubilidade do dicromato de potássio na água em função da temperatura, foi apresentado em uma aula prática sobre misturas e suas classificações. Em seguida, foram preparadas seis misturas sob agitação enérgica, utilizando dicromato de potássio sólido e água pura em diferentes temperaturas, conforme o esquema:
Após a estabilização dessas misturas, o número de sistemas homogêneos e o número de sistemas heterogêneos formados correspondem, respectivamente,
(A) 5 - 1
(B) 4 - 2
(C) 3 - 3
(D) 1 - 5
(E) 3 - 4
2. (FATEC) A partir do gráfico a seguir são feitas as afirmações de I a IV.
I. Se acrescentarmos 250 g de NH4NO3 a 50 g de água a 60 °C, obteremos uma solução saturada com corpo de chão.
II. A dissolução, em água, do NH4NO3 e do NaI ocorre com liberação e absorção de calor, respectivamente.
III. A 40 °C, o NaI é mais solúvel que o NaBr e menos solúvel que o NH4NO3.
IV. Quando uma solução aquosa saturada de NH4NO3, inicialmente preparada a 60 °C, for resfriada a 10 °C, obteremos uma solução insaturada.
Está correto apenas o que se afirma em
(A) I e II.
(B) I e III.
(C) I e IV.
(D) II e III.
(E) III e IV.
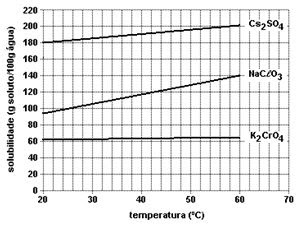
3. (UFRGS) Observe o gráfico a seguir, que representa a variação da solubilidade de sais com a temperatura.
Assinale com V (verdadeiro) ou F (falso) as seguintes afirmações, feitas por um estudante ao tentar interpretar esse gráfico.
( ) O cloreto de sódio e o sulfato de lítio apresentam solubilidade constante no intervalo considerado.
( ) No intervalo de O °C a 100 °C, a solubilidade do iodeto de potássio é aproximadamente duas vezes maior que a do nitrato de sódio.
( ) O nitrato de prata é o sal que apresenta o maior valor de solubilidade a O °C.
( ) A solubilidade do iodeto de potássio a 100 °C é aproximadamente igual a 200 g/L.
( ) Quatro dos sais mostrados no gráfico apresentam aumento da solubilidade com a temperatura no intervalo de O °C a 35 °C.
( ) A 20 °C, as solubilidades do cloreto de sódio e só sulfato de sódios são iguais.
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
(A) V - F- V - F - F - F.
(B) F - V - F - V - F - F.
(C) F - F - F - F - V - V.
(D) V - F - F - V - F - V.
(E) F- V - V - F - V - F.
4. (PUCRIO) Observe o gráfico a seguir.
A quantidade de clorato de sódio capaz de atingir a saturação em 500 g de água na temperatura de 60 °C, em grama, é aproximadamente igual a
(A) 70
(B) 140
(C) 210
(D) 480
(E) 700
5. (UFMG) Numa aula no Laboratório de Química, os alunos prepararam, sob supervisão do professor, duas soluções aquosas, uma de cloreto de potássio, KCℓ, e uma de cloreto de cálcio, CaCℓ2. Após observarem a variação da temperatura em função do tempo, durante o preparo de cada uma dessas soluções, os alunos elaboraram este gráfico:
Considerando-se as informações fornecidas por esse gráfico e outros conhecimentos sobre o assunto, é CORRETO afirmar que
(A) a dissolução do CaCℓ2 diminui a energia cinética média das moléculas de água.
(B) a dissolução do KCℓ é um processo exotérmico.
(C) a entalpia de dissolução do CaCℓ2 é maior que zero.
(D) a solubilidade do KCℓ aumenta com o aumento da temperatura.
6. (UFAL) Considere os seguintes dados:
- Solubilidade em água à temperatura ambiente.
- NaNO3 ... 90 g/100 g de H2O; massa molar (g/mol) = 85.
Sua solubilidade aumenta quando aumenta a temperatura.
- NaCℓ ... 38 g/100 g de H2O; massa molar (g/mol) = 58.
Sua solubilidade é praticamente constante quando aumenta a temperatura.
- Ce2(SO4)3 ... 5 g/100 g de H2O
Sua solubilidade diminui quando aumenta a temperatura.
Com esses dados, afirma-se que
(A) À temperatura ambiente, quando a solubilidade é expressa em mol do soluto/100 g H2O, o NaCℓ é mais solúvel do que o NaNO3.
(B) À temperatura ambiente, uma solução saturada de NaCℓ contém mais mols de íons Na+ do que uma solução saturada de NaNO3.
(C) A dissolução de NaNO3 em água é um processo endotérmico.
(D) A dissolução do NaCℓ em água deve ocorrer com pequeno efeito térmico.
(E) A dissolução do Ce2(SO4)3 em água deve ocorrer com liberação de energia.
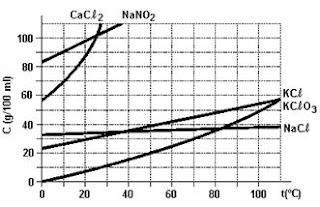
7. (PUCMG) O gráfico representa as curvas de solubilidade de alguns sais em água.
De acordo com o gráfico, podemos concluir que
(A) a substância mais solúvel em água a 40 °C é o nitrito de sódio.
(B) a temperatura não afeta a solubilidade do cloreto de sódio.
(C) o cloreto de potássio é mais solúvel que o cloreto de sódio à temperatura ambiente.
(D) a massa de clorato de potássio capaz de saturar 200 mL de água, a 30 °C, é de 20 g.
8. (PUCSP) O gráfico a seguir representa a curva de solubilidade do nitrato de potássio (KNO3) em água.
A 70 °C, foram preparadas duas soluções, cada uma contendo 70 g de nitrato de potássio (KNO3) e 200 g de água. A primeira solução foi mantida a 70 °C e, após a evaporação de uma certa massa de água (m), houve início de precipitação do sólido. A outra solução foi resfriada a uma temperatura (t) em que se percebeu o início da precipitação do sal.
A análise do gráfico permite inferir que os valores aproximados da massa m e da temperatura t são, respectivamente,
(A) m = 50 g e t = 45 °C
(B) m = 150 g e t = 22 °C
(C) m = 100 g e t = 22 °C
(D) m = 150 g e t = 35 °C
(E) m = 100 g e t = 45 °C
9. (CPS) Em uma das Etecs, após uma partida de basquete sob sol forte, um dos alunos passou mal e foi levado ao pronto-socorro.
O médico diagnosticou desidratação e por isso o aluno ficou em observação, recebendo soro na veia.
No dia seguinte, a professora de Química usou o fato para ensinar aos alunos a preparação do soro caseiro, que é um bom recurso para evitar a desidratação.
Soro Caseiro
Um litro de água fervida
Uma colher (de café) de sal
Uma colher (de sopa) de açúcar
Após a explicação, os alunos estudaram a solubilidade dos dois compostos em água, usados na preparação do soro, realizando dois experimentos:
I. Pesar 50 g de açúcar (sacarose) e adicionar em um béquer que continha 100 g de água sob agitação.
II. Pesar 50 g de sal (cloreto de sódio) e adicionar em um béquer que continha 100 g de água sob agitação.
Após deixar os sistemas em repouso, eles deveriam observar se houve formação de corpo de chão (depósito de substância que não se dissolveu). Em caso positivo, eles deveriam filtrar, secar, pesar o material em excesso e ilustrar o procedimento.
Um grupo elaborou os seguintes esquemas:
Analisando os esquemas elaborados, é possível afirmar que, nas condições em que foram realizados os experimentos,
(A) o sistema I é homogêneo e bifásico.
(B) o sistema II é uma solução homogênea.
(C) o sal é mais solúvel em água que a sacarose.
(d) a solubilidade da sacarose em água é 50 g por 100 g de água.
(E) a solubilidade do cloreto de sódio (NaCℓ) em água é de 36 g por 100 g de água.
10. (ENEM) Devido ao seu alto teor de sais, a água do mar é imprópria para o consumo humano e para a maioria dos usos da água doce. No entanto, para a indústria, a água do mar é de grande interesse, uma vez que os sais presentes podem servir de matérias-primas importantes para diversos processos. Nesse contexto, devido a sua simplicidade e ao seu baixo potencial de impacto ambiental, o método da precipitação fracionada tem sido utilizado para a obtenção dos sais presentes na água do mar.
Tabela 1: Solubilidade em água de alguns compostos presentes na água do mar a 25 ºC
|
SOLUTO
|
FÓRMULA
|
SOLUBILIDADE
g/kg de H2O
|
|
Brometo de sódio
|
NaBr
|
1,20 x 103
|
|
Carbonato de cálcio
|
CaCO3
|
1,30 x 10-2
|
|
Cloreto de sódio
|
NaCℓ
|
3,60 x 102
|
|
Cloreto de magnésio
|
MgCℒ2
|
5,41 x 102
|
|
Sulfato de magnésio
|
MgSO4
|
3,60 x 102
|
|
Sulfato de cálcio
|
CaSO4
|
6,80 x 10-1
|
Suponha que uma indústria objetiva separar determinados sais de uma amostra de água do mar a
25 °C, por meio da precipitação fracionada. Se essa amostra contiver somente os sais destacados na tabela, a seguinte ordem de precipitação será verificada.
(A) Carbonato de cálcio, sulfato de cálcio, cloreto de sódio e sulfato de magnésio, cloreto de magnésio e, por último, brometo de sódio.
(B) Brometo de sódio, cloreto de magnésio, cloreto de sódio e sulfato de magnésio, sulfato de cálcio e, por último, carbonato de cálcio.
(C) Cloreto de magnésio, sulfato de magnésio e cloreto de sódio, sulfato de cálcio, carbonato de cálcio e, por último, brometo de sódio.
(D) Brometo de sódio, carbonato de cálcio, sulfato de cálcio, cloreto de sódio e sulfato de magnésio e, por último, cloreto de magnésio.
(E) Cloreto de sódio, sulfato de magnésio, carbonato de cálcio, sulfato de cálcio, cloreto de magnésio e, por último, brometo de sódio.
Gabarito
1[B] 2[B] 3[C] 4[E] 5[D] 6 FFVVV 7[D] 8[B] 9[E] 10[A]